Um novo estudo publicado nesta segunda-feira (19) na revista Nature Medicine mostra uma evolução significativa nos dispositivos conhecidos como marcapassos cerebrais no tratamento de Parkinson. A nova tecnologia, ainda preliminar, permite, por meio do monitoramento da atividade cerebral, que a estimulação elétrica se adapte, auxiliando na execução de movimentos prejudicados pela doença.
Os pesquisadores, das Universidades da Califórnia e da Pensilvânia, implantaram os dispositivos de estimulação cerebral profunda (DBS, na sigla em inglês) em quatro pacientes.
Atualmente, a estimulação cerebral profunda contínua (cDBS), ou seja, uma estimulação de intensidade constante com eletrodos inseridos nas regiões do cérebro afetadas pela doença, como o núcleo subtalâmico ou a porção interna do globo pálido, é a abordagem padrão.
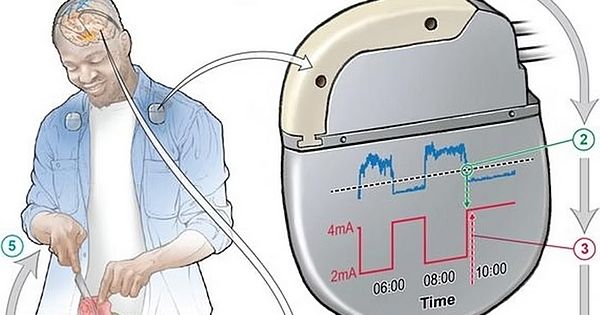
A novidade é a possibilidade de um estímulo adaptativo (aDBS), que considera as necessidades de cada paciente a cada momento, como maior estímulo elétrico quando o efeito da dose de medicamento começa a reduzir. Isso é feito a partir da leitura da atividade cerebral, com outros eletrodos.
De forma geral, a estimulação profunda, tanto contínua quanto adaptativa, reduz a quantidade necessária de medicamentos, como a levodopa, mas a adaptativa tem potencial para reduzir efeitos indesejados, como insônia e movimentos involuntários.
O estudo foi engenhoso. Cada um dos pacientes passou pela cirurgia para receber os eletrodos e o dispositivo, que poderia funcionar tanto como cDBS quanto como aDBS. No início, porém, toda a otimização foi feita para a cDBS, padrão atualmente utilizado, e somente essa etapa durou entre sete e 31 meses.
Depois, foi a vez do desenvolvimento dos algoritmos que embasam o funcionamento da aDBS, para definir, a partir da leitura da atividade cerebral, quando deveria haver estímulo elétrico e em qual intensidade.
A parte de personalização contou com a identificação de oscilações (variações) no núcleo subtalâmico ou no córtex motor como marcadores neurais ideais para determinar os estados de alta ou baixa dopamina -o neurotransmissor deficiente na doença-, ajustando a estimulação de acordo. Essa etapa levou até seis meses para ser finalizada.
Finalmente, aconteceu a comparação entre aDBS e cDBS. O paciente recebeu alternadamente os estímulos de forma cega, ou seja, sem saber qual era qual. Em cada período, registrava os sintomas e queixas em questionários digitais.
A aDBS foi capaz de reduzir o tempo em que os pacientes sofrem com sintomas motores incômodos, mesmo aqueles que persistiam mesmo com a cDBS otimizada. Com a forma contínua, os sintomas negativos estavam presentes entre 22,7% e 36,3% do tempo; com a estimulação adaptativa, ficou entre 10,2% e 16,3% -no melhor caso, a redução foi de quase 60%.
“Nossa abordagem à DBS adaptativa é bastante promissora, e um de seus benefícios é que ela requer muito pouco treinamento do paciente -o sistema automaticamente prevê os sintomas a partir dos sinais cerebrais e ajusta a estimulação conforme necessário”, afirmam as pesquisadoras Lauren Hammer, Carina Oehrn e Stephanie Cernera, em entrevista por email à reportagem.
De acordo com elas, a progressão da doença e a piora dos sintomas requerem ajustes nas configurações de estimulação. “Esperamos que a aDBS possa necessitar de ajustes semelhantes, e estudos de maior duração com mais pacientes serão necessários para avaliar se a aDBS oferece benefícios contínuos em comparação com a cDBS.”
Elas relatam que muitos dos dispositivos comercialmente disponíveis têm um sistema que já seria compatível com a nova tecnologia. “No entanto, a configuração dos sistemas aDBS neste estudo exigiu muitas horas de trabalho de especialistas com conhecimento específico. Mesmo com educação significativa dos profissionais de saúde, replicar os métodos do estudo seria demais para se encaixar em uma consulta padrão de consultório médico. A adoção ampla para o uso clínico exigirá uma forma mais simples e automatizada de configuração.”
Mas existe um gargalo anterior à implementação do aDBS: a implementação da tecnologia atual, a cDBS. Segundo Denis Bichuetti, professor de neurologia da Unifesp (Universidade Federal de São Paulo), a estimulação profunda cerebral faz parte da rotina de tratamento, mas sua aplicação é limitada a centros especializados.
“É essencial que o sistema de saúde esteja preparado para adaptar essas inovações [como a aDBS], superando barreiras como custo e complexidade técnica. No entanto, é importante ressaltar que, mesmo com as limitações, a DBS oferece uma alternativa valiosa para pacientes que não respondem bem ao tratamento medicamentoso convencional”, diz.
O médico explica que os pacientes que mais podem se beneficiar do procedimento são aqueles que já utilizam medicamentos em quantidade relevante, mas que não estão com a doença em estágio avançado. No tratamento com a estimulação, a quantidade necessária de medicamento é reduzida, sendo possível ganhar tempo no controle da doença.
Nos EUA, apesar da disponibilidade e da cobertura por seguros-saúde, a DBS ainda é pouco utilizada, especialmente pela falta de conscientização por parte de médicos e pacientes sobre seus potenciais benefícios, dizem as autoras. Hoje, o pacote completo envolvendo cirurgia, honorários e custos hospitalares pode somar “dezenas de milhares de dólares”. No Brasil, considerando o cenário particular, o pacote pode custar cerca de R$ 200 mil.
Entre os próximos passos para a pesquisa está a automação do processo de configuração da aDBS, o que vai agilizar o uso por novos pacientes. Outra possibilidade é ampliar a quantidade de sinais neurais captados, ajudando a criar o que seria uma espécie de “impressão digital” de diferentes sintomas motores e não motores, permitindo um tratamento ainda mais personalizado.
Ainda é possível, dizem os autores, estudar o emprego dessa estimulação cerebral ajustada por sintomas em condições como depressão, TOC (transtorno obsessivo-compulsivo) e transtorno de estresse pós-traumático.